一次性医用口罩防护服办理欧盟CE认证欧代注册需要什么资料
- 供应商
- 深圳万检通检验机构
- 认证
- 联系电话
- 13543507220
- 手机号
- 13543507220
- 联系人
- 黎小姐
- 所在地
- 深圳市宝安区航城街道三围社区航空路36号华盛泰D栋3F
- 更新时间
- 2024-12-22 08:30
欧盟授权代表要站在制造商的立场,与欧盟主管当局进行沟通(关于符合性申明书,欧盟标签和语言要求,事故报告,临床研究的通告,自由销售证明或市场准入证明,以及产品注册证明等问题)。
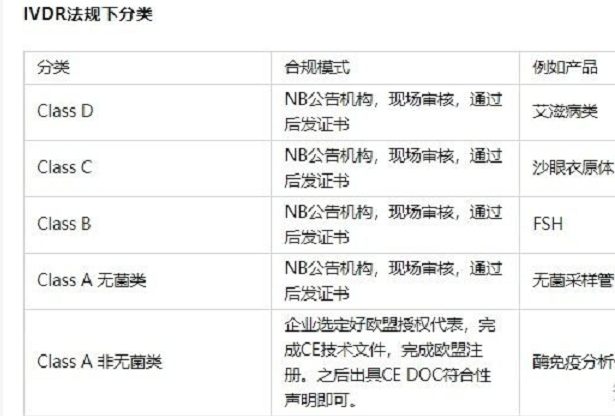
按照医疗器械法规2017/745/eu的要求,口罩产品可以按照一类器械进行管理。依据产品是无菌或非无菌状态提供,其认证模式不一样。
1.非无菌方式提供
1)编制技术文件;
2)提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告);
3)编制doc;
4)指定欧盟授权代表并完成欧盟注册;
为了更好的保护欧盟消费者的权益,实现产品的可追溯性,根据欧盟的法规要求,制造商投放到欧盟市场的加贴了ce标志的产品必须有制造商的名称和联系地址;如果制造商来自欧洲经济区eea(包括eu与efta)以外的国家,其产品必须同时标有制造商和欧盟授权代表的名称和联系地址。欧盟的医疗器械指令:93/42/eec,90/385/eec,98/79/ec覆盖了所有的医疗器械产品,这三个指令均要求非欧盟制造商必须要有欧盟授权代表。欧盟新的mdr(2017/745)法规和ivdr(2017/746)法规也明确规定了授权代表在确保欧盟以外制造商生产的器械符合性,以及作为其在欧盟建立的联系人方面要发挥关键作用。