欧盟医疗器械新法规MDR和IVDR怎么做?采样拭子CE欧代注册
- 供应商
- 深圳万检通检验机构
- 认证
- 联系电话
- 13543507220
- 手机号
- 13543507220
- 联系人
- 黎小姐
- 所在地
- 深圳市宝安区航城街道三围社区航空路36号华盛泰D栋3F
- 更新时间
- 2024-12-22 08:30
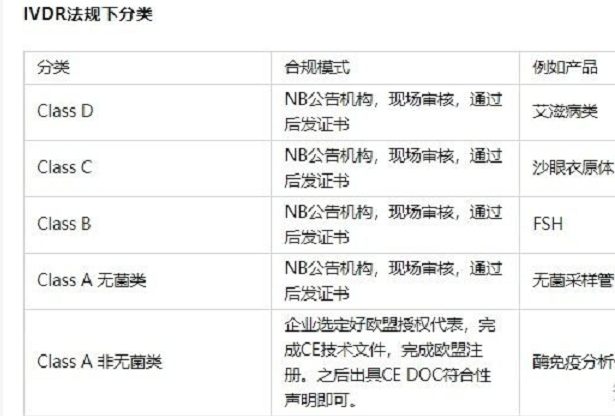
2017 年5 月5 日欧盟国家医疗设备政策法规(mdr)和血液制品医疗设备政策法规(ivdr)宣布公布,于2017 年5月25日宣布起效,并各自于2020 年5 月26 日和2022 年5 月26 日执行。自实施之日起,mdr 和ivdr将各自替代原欧盟国家医疗设备命令(mdd)和血液制品机器设备命令(ivdd)。
因此,在ivdd政策法规架构下“自身声称”类的商品,因为不涉及到ce资格证书,故必须在执行日前进行ivdr政策法规的转换;一小部分在ivdd政策法规架构下涉及到ce资格证书的商品,必须在资格证书有效期限内进行ivdr政策法规的转换,但不可晚于执行后的2年。
后面.
欧盟国家区是各医疗设备生产商关键市场定位之一,也是全世界*二大的血液制品机器设备销售市场。达到ivdr政策法规的标准对各生产商有着毋庸置疑的关键作用,各生生产商在未来的数年内都必须对于此事进行如火如荼的政策法规追踪及执行工作中。