医疗器械英国UKCA认证NI跟GB准入要求
- 供应商
- 国瑞中安集团-CRO服务机构
- 认证
- 联系电话
- 17324419148
- 手机号
- 17324419148
- 经理
- 陈经理
- 所在地
- 深圳市光明区光源五路宝新科技园一期2#一层
- 更新时间
- 2024-12-25 07:07
1.英国的立法是什么?
关于英国
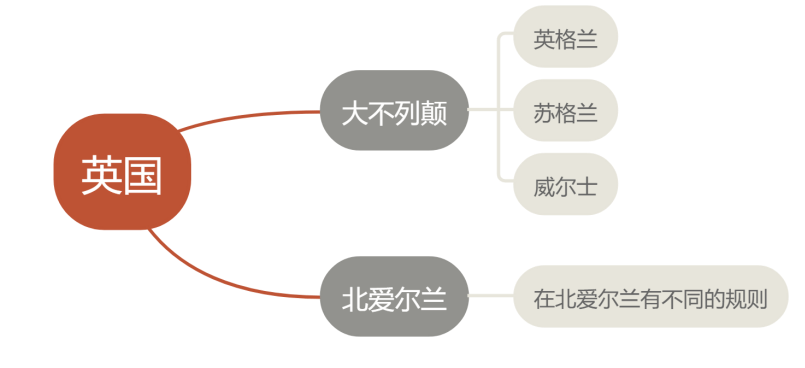
英国的立法:uk mdr 2002
uk medicaldevices regulations 2002(si 2002 no 618, as amended)
大不列颠(gb) | part ii:general medical devices | mdd |
partiii: active implantable medical devices | aimdd | |
part iv:in vitro diagnostic devices | ivdd | |
eu mdr 以及 euivdr 不适用于大不列颠 | ||
北爱尔兰(ni) | eu mdr 于2021年5月26日起适用 | |
eu ivdr 将于2022年5月26日适用 |
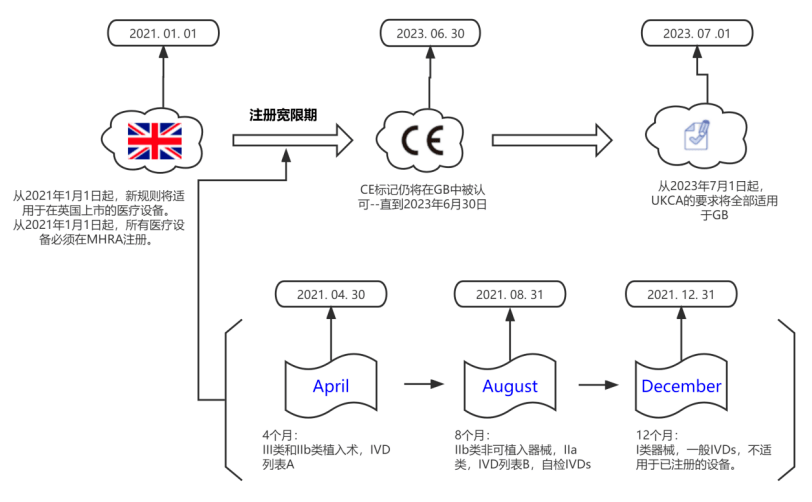
2. ukmdr 2022的实施时间

3.制造商需要在什么时候采取行动?
4.英国批准机构(ukab)
什么是英国批准机构?
—由药品和保健产品监管机构(mhra)指定的组织,负责评估制造商及其医疗器械是否符合2002《医疗器械条例》(经修订的si2002 no 618)的要求。
—根据英国mdr2002的第ii、iii、iv部分进行的gb评估
—根据eu mdr或euivdr对ni进行评估
—原设在英国的欧盟国家统计局自动成为ukab(自2021年1月1日起)
—nando被ukmcab(英国市场合格评定机构)取代
5.在北爱尔兰市场投放产品
ni有什么不同?
—脱欧协议的一部分
—与爱尔兰(欧盟的一部分)没有硬边界
爱尔兰岛上建立单一监管和贸易区
—eumd法规适用于ni
—eumdr(2021年5月26日),eu ivdr(2022年5月26日)
—进入ni市场需要ce标记(如果有ukab,需要ukni标记)
ni企业“自由”进入gb市场
6.北爱尔兰的法规要求
向mhra注册设备
a.大多数设备都需要注册
—第i类仪器、定制仪器及一般ivd除外-已在欧盟ca*仅适用于ni市场
b. 2021年1月1日:i类设备、定制设备和一般ivd
c. 2021年5月1日:iii类和iib类可植入产品,以及所有主动可植入医疗设备和ivd list a产品
d. 2021年9月1日:其他iib类和所有iia类设备和ivd清单b产品和自检ivd
ukrp和授权代表
a.如果制造商位于英国以外,ukrp要求
—包括欧盟、欧洲经济区和欧盟第三国
—如果eu ar位于ni- ukrp不需要
b.需要从2021年1月1日起生效
c.gb制造商将需要eu或ni ar
d.向mhra注册设备
—由ukrp或niar
e.单一实体可以是基于ni的ukrp和ar
标签
a. 接受ce标志(eunb)
b.接受ukni标记(如果涉及ukab)&同时有ce
c. 欧盟不接受ce +ukni
d.*不受限制地访问gb
—nimfrs可访问gb
—ni的ce访问继续进行>2023年6月30日
e.ukab的评估在欧盟不被认可
f.ukni不被欧盟接受