医疗器械CE认证IVDR分类流程
- 供应商
- 国瑞中安集团-CRO服务机构
- 认证
- 联系电话
- 17324419148
- 手机号
- 17324419148
- 经理
- 陈经理
- 所在地
- 深圳市光明区光源五路宝新科技园一期2#一层
- 更新时间
- 2025-01-01 07:07
基于风险的 ivdr分类
对特定 ivd 施加的ivdr 法规的严格程度完全取决于其指定的风险等级。根据ivdd,只有两个广泛列表中提到的 ivd 被归类为前两个风险类别。
然后将剩余的体外诊断设备分为“自我测试”类别或“体外诊断其他”类别。在ivdr 下,它们现在根据 ivdr 附件 viii 中所述的一组规则分为从 a(低风险)到 d(zui高风险)的类别。
下图说明了 ivdd下基于列表的方法与 ivd 基于风险的 ivdr 分类程序的对比。
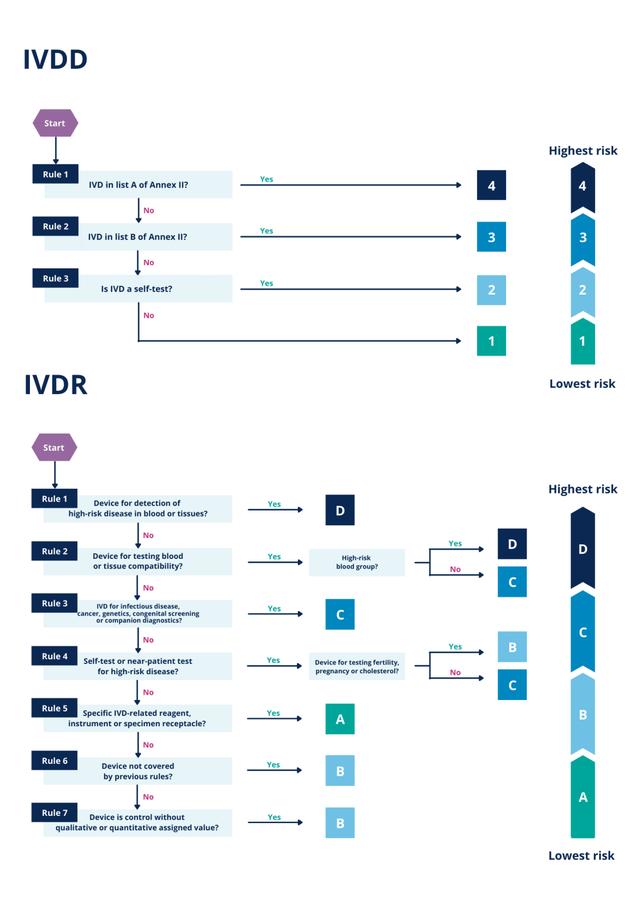
图 1 – 描述 ivdd 和 ivdr下分类过程的流程图。
根据ivdd使用的基于列表的方法,大多数 ivd被归为zui低风险等级(“ivd其他”),不需要指定机构的批准或参与。更广泛的 ivdr 分类程序将所有 ivd 中的大部分分类为高风险等级。
这些高风险等级也需要经过公告机构的批准。图 3说明了产品从不需要批准的低风险类别到需要公告机构批准的较高风险类别的转变。因此,与引入 ivdr 之前相比,对于许多ivd而言,要求的严格性显着增加。
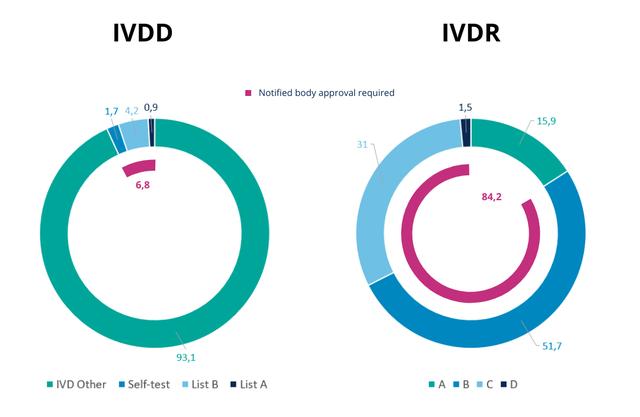
图 2 – ivdd 与 ivdr 下的分类比例比较。
从这个角度来看,我们可以看一下sars-cov2诊断测试的例子,很明显这种新的 ivdr 分类可以产生多大的影响。在 ivdd 下,这些测试属于zui低风险等级,而在ivdr 下它们属于 d 级,即zui高风险等级。因此,制造sars-cov2 测试需要指定机构的批准和单个批次由参考实验室进行测试。
ivdr截止日期临近:现在怎么办?
新的 ivdr统一了对各种 ivd 的监管,确保了整个欧洲患者和公众的安全。
由于引入了更完整的基于规则的 ivdr 分类系统,现在大约84%的 ivd需要得到指定机构的批准,而之前这一比例不到7%。
ivdr的实施导致需要对许多 ivd 进行重新分类以及认证或重新认证。